Thứ sáu, 17/01/2020,07:51 (GMT+7)

Hoàn thiện cơ chế quản lý chất lượng trang thiết bị y tế
Trang thiết bị y tế là loại hàng hóa đặc biệt, có ảnh hưởng trực tiếp đến sức khỏe con người. Tuy nhiên, cơ chế quản lý chất lượng mặt hàng này ở nước ta chưa chặt chẽ, cần được thực hiện ở đầy đủ các khâu, từ nghiên cứu sản xuất, nhập khẩu đến khai thác sử dụng.

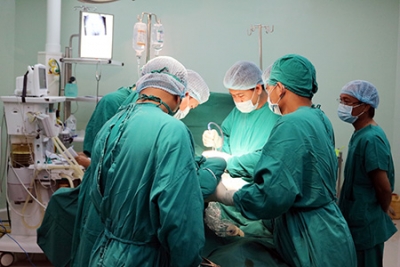
Bác sĩ Bệnh viện Hữu nghị Việt Ðức sử dụng kính vi phẫu trong phẫu thuật thần kinh.
Trang thiết bị y tế (TTBYT) ngày càng đóng vai trò quan trọng trong chẩn đoán, điều trị và phòng bệnh; là một yếu tố quan trọng quyết định hiệu quả, chất lượng của công tác y tế. TTBYT là một trong ba yếu tố (cùng đội ngũ nhân lực và thuốc) quyết định hiệu quả, chất lượng của công tác chăm sóc, bảo vệ và nâng cao sức khỏe nhân dân. Do vậy, để nâng cao chất lượng khám, chữa bệnh, dự phòng, cần khẩn trương kiện toàn ba yếu tố nêu trên. Nếu như nâng cao chất lượng đội ngũ nhân lực (bằng đào tạo, bồi dưỡng); quản lý chất lượng thuốc đã có Luật Dược và cần quy định bổ sung, cập nhật các quy định nếu cần thiết thì TTBYT vẫn còn khá nhiều khoảng trống.
Hiện nay, chưa có quy định cụ thể về quản lý chất lượng TTBYT, Bộ Khoa học và Công nghệ mới quy định một số thiết bị đo nhóm hai sử dụng trong y tế phải kiểm định về đo lường (bao gồm: Nhiệt kế y học, áp kế, huyết áp kế, máy điện tim, điện não và quy định về kiểm định an toàn bức xạ). Nghị định 36/NÐ-CP về quản lý thiết bị y tế và Nghị định 169/NÐ-CP sửa đổi, bổ sung một số điều của Nghị định 36/NÐ-CP đã bổ sung nội dung kiểm định an toàn và tính năng kỹ thuật thiết bị y tế, thiết bị y tế loại B,C,D là thiết bị nhóm hai theo quy định của Luật Chất lượng sản phẩm hàng hóa. Nhiều chuyên gia lĩnh vực này chỉ rõ, theo Luật Chất lượng sản phẩm hàng hóa, hoạt động kiểm định chất lượng phải dựa theo Quy chuẩn kỹ thuật tương ứng. Nhưng đến nay, Bộ Y tế chưa xây dựng quy chuẩn kỹ thuật quốc gia cho thiết bị y tế.
Về nguyên tắc, TTBYT phải được quản lý chất lượng cả ba giai đoạn theo Công ước quốc tế ASEAN về quản lý Trang thiết bị y tế (AMDD) như sau: Giai đoạn tiền thị trường (là giai đoạn nghiên cứu thiết kế, chế tạo, thử nghiệm, chứng nhận hợp chuẩn hợp quy, thử tiền lâm sàng, thử lâm sàng, hoàn thiện công nghệ, sản xuất ra sản phẩm TTBYT); giai đoạn thị trường (TTBYT lưu thông trên thị trường); giai đoạn hậu thị trường (giai đoạn đầu tư, mua sắm, khai thác sử dụng TTBYT tại các đơn vị sử dụng). Hiện nay, nước ta cũng thực hiện quản lý chất lượng ở cả ba giai đoạn, nhưng ở mức khác nhau. Giai đoạn tiền thị trường cũng chưa có đơn vị nào tổ chức thử nghiệm, chứng nhận hợp chuẩn, hợp quy; TTBYT nghiên cứu sản xuất chưa được đánh giá theo bộ quy tắc thiết yếu (19 quy tắc) trong đó có sáu quy tắc bắt buộc để bảo đảm tính đặc thù về an toàn và tính năng hoạt động của TTBYT. Ở giai đoạn thị trường, đã có sự tham gia của Bộ Công thương, Tổng cục Hải quan (Bộ Tài chính) và Bộ Y tế (Bộ Y tế hiện cấp phép nhập khẩu TTBYT theo đơn hàng, chưa áp dụng số đăng ký lưu hành). Hiện tất cả TTBYT loại B-C-D (nhóm hai theo quy định tại Nghị định 36-NÐ-CP) chưa được kiểm tra chất lượng hàng hóa nhập khẩu. Giai đoạn hậu thị trường, hiện mới có sáu loại TTBYT (trong số hơn 10 nghìn chủng loại TTBYT đang khai thác sử dụng tại các cơ sở y tế) được quy định phải kiểm định về đo lường và an toàn bức xạ; chưa có quy định về quản lý chất lượng các loại TTBYT còn lại.
Nghị định 36/NÐ-CP đã ban hành và thống nhất quản lý về TTBYT hài hòa cơ bản với các quy định của AMDD. Theo đó, TTBYT được chia làm bốn nhóm theo nguy cơ rủi ro (nhóm A: rủi ro thấp; nhóm B: rủi ro trung bình - thấp; nhóm C: rủi ro trung bình - cao và nhóm D: rủi ro cao). Mức độ tăng cường quản lý sẽ tăng lên theo mức độ rủi ro của sản phẩm. Về cơ bản, các TTBYT muốn được lưu hành trên thị trường cần chứng minh tính an toàn và các nguyên tắc thiết yếu bảo đảm sự an toàn và tính năng cơ bản. Ðể chứng minh việc phù hợp nguyên tắc thiết yếu, các thiết bị y tế cần phải đáp ứng các tiêu chuẩn, quy chuẩn kỹ thuật tương ứng hoặc phải chứng minh được tính an toàn, phù hợp qua các hoạt động kiểm tra, so sánh đánh giá, kiểm nghiệm và thử nghiệm lâm sàng. Ðây là nội dung chính của hoạt động quản lý chất lượng TTBYT và là khâu quan trọng nhất trong bước quản lý tiền thị trường sản phẩm TTBYT đồng thời là tiền đề để hậu kiểm. Tại hầu hết các quốc gia hiện nay, việc đánh giá chất lượng TTBYT để phục vụ công tác quản lý tiền thị trường do các tổ chức chuyên môn thực hiện. Các tổ chức đánh giá chất lượng TTBYT đóng vai trò phối hợp cơ quan chức năng qua các hoạt động đánh giá kỹ thuật và phân loại rủi ro.
Từ phân tích nêu trên, các chuyên gia trong lĩnh vực TTBYT cho rằng cần sớm hoàn thiện các văn bản quy phạm pháp luật về quản lý chất lượng TTBYT đáp ứng đòi hỏi ngày càng cao của xã hội. Cần quy định rõ hoạt động quản lý chất lượng trang thiết bị; hoạt động kiểm định kỹ thuật về an toàn và tính năng TTBYT làm cơ sở cho việc xây dựng hệ thống bảo đảm chất lượng TTBYT đa tầng. Ban hành danh mục TTBYT cần kiểm định ngay; xây dựng các quy trình kỹ thuật kiểm định; tổ chức đào tạo nhân lực kiểm định cho hệ thống; giúp Bộ Y tế về chuyên môn kỹ thuật trong tổ chức đào tạo, đào tạo lại và giám sát kỹ thuật đối với toàn bộ hệ thống. Trong đó, xây dựng, phát triển hệ thống quản lý chất lượng TTBYT đa tầng là phù hợp. Ðồng thời, đầu tư xây dựng hệ thống phòng thí nghiệm thử nghiệm - chứng nhận - kiểm định - giám định kỹ thuật về an toàn và tính năng TTBYT.
QUANG MINH - (nhandan.com.vn)
T/h: H.Phong - (dongbang.vn)
Cùng chuyên mục
Tin mới
Tin tiêu biểu