3 lô vắc-xin Combe Five không đạt chất lượng khi kiểm định
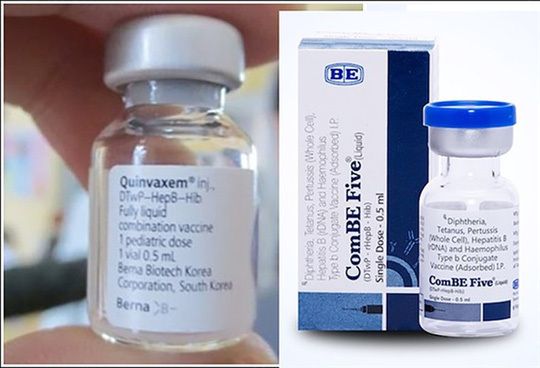
Theo Bộ Y tế, việc ngừng sử dụng vắc-xin Quinvaxem (có thành phần ho gà toàn tế bào, phòng 5 bệnh bạch hầu-ho gà-uốn ván, viêm gan B, viêm màng não mủ do Hib) cho trẻ em trong chương trình tiêm chủng mở rộng là do tập đoàn vắc-xin Janssen tại Hàn Quốc đã ngừng sản xuất và cung ứng cho Việt Nam loại vắc-xin này từ ngày 15-12-2017.
Ngay sau khi có thông báo của nhà sản xuất, Bộ Y tế đã lựa chọn vắc-xin ComBE Five do Công ty Biological E, Ấn Độ sản xuất. Đây là loại vắc-xin có thành phần tương tự vắc-xin Quinvaxem và đã được Tổ chức Y tế Thế giới (WHO) tiền thẩm định, đã được sử dụng trên 72 quốc gia, với khoảng 362 triệu liều đã được sử dụng.
Sau khi lựa chọn vắc-xin, Bộ Y tế đã tiến hành các thủ tục mua sắm, nhập khẩu tuân thủ các quy định hiện hành và theo chỉ đạo của Chính phủ. Đồng thời, Bộ Y tế đã xây dựng kế hoạch chuyển đổi chi tiết việc sử dụng loại vắc-xin này thay thế vắc-xin Quinvaxem trong chương trình tiêm chủng mở rộng, bước đầu dự kiến triển khai tại 7 tỉnh trước khi triển khai trên quy mô toàn quốc.
Theo quy định, để bảo đảm vắc-xin an toàn, chất lượng, hiệu quả trước khi đưa vào sử dụng, tất cả các loại vắc-xin đều phải tuân thủ việc kiểm định nghiêm ngặt, chặt chẽ. Vì vậy, Bộ Y tế đã chỉ đạo Dự án tiêm chủng mở rộng quốc gia (Bộ Y tế) ngày 8-6-2018 nhập 3 lô vắc-xin ComBE Five do Liên minh toàn cầu về vắc xin và tiêm chủng (GAVI) viện trợ cho Việt Nam thông qua Quỹ Nhi đồng Liên Hiệp Quốc (UNICEF) để tiến hành kiểm định trước khi đưa vào sử dụng. Tuy nhiên, kết quả kiểm định chất lượng 3 lô vắc-xin này chưa đạt kết quả như mong muốn.
Sau sự cố này, Bộ Y tế tiếp tục yêu cầu nhà sản xuất tiếp tục cung cấp lô vắc-xin mới để tiến hành kiểm định. Ngày 10-9-2018, kết quả kiểm định lô vắc-xin mới này đạt yêu cầu. Ngay sau khi có kết quả kiểm định đạt yêu cầu của lô vắc-xin mới này, Bộ Y tế đã chỉ đạo các Vụ, Cục, đơn vị liên quan khẩn trương tiến hành thủ tục mua sắm theo quy định để sớm đưa vắc-xin ComBE Five vào chương trình tiêm chủng để tiêm phòng cho trẻ.
Trong thời gian chờ có vắc-xin mới, Bộ Y tế tiếp tục chỉ đạo dự án tiêm chủng mở rộng và các địa phương tiến hành rà soát, cân đối, điều phối sử dụng vắc-xin hiện có trong toàn hệ thống để bảo đảm sự thiếu hụt vắc-xin đến mức thấp nhất. Đồng thời, Bộ Y tế sẽ có văn bản yêu cầu Sở Y tế chỉ đạo các cơ sở tiêm chủng chủ động lập kế hoạch, rà soát và tiến hành tiêm bù cho những trẻ chưa được tiêm đủ các mũi vắc-xin ComBE Five khi lô vắc-xin này hoàn thành các thủ tục mua sắm để chuyển đổi, thay thế vắc-xin Quinvaxem trong chương trình tiêm chủng mở rộng.
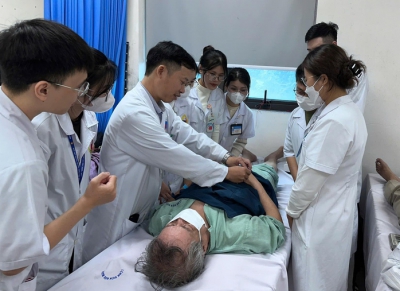
Tại Việt Nam, vắc-xin ComBE Five đã được sử dụng tại 4 huyện của tỉnh Hà Nam từ tháng 9-2016 đến 1-2017. Kết quả, sau tiêm chủng chỉ ghi nhận một số phản ứng thông thường xuất hiện vào ngày thứ nhất sau tiêm vắc-xin bao gồm: Phản ứng tại chỗ tiêm đau, quầng đỏ với tỉ lệ từ 5-15%. Sốt với tỉ lệ 34-39%. Không nghi nhận bất kỳ phản ứng nặng nào sau tiêm chủng.